
O ano era 1866: em um mosteiro na cidade de Brno (na atual República Tcheca), um monge cientista olhava atentamente para vasos de ervilhas em busca de semelhanças, diferenças e padrões entre as plantas. Seu nome era Gregor Mendel e ele tinha certeza de que o estudo era interessante. Talvez não se desse conta, porém, de que suas observações, sobre as leis da hereditariedade, acabariam por transformá-lo no fundador de uma nova ciência: a Genética!

Cento e cinquenta anos depois, os estudos genéticos avançaram de uma forma que impressionaria o próprio Mendel, em uma jornada que passa por descobertas marcantes: a identificação dos cromossomos como portadores dos genes (Thomas Morgan, 1910), a confirmação de que o DNA é o material genético (Avery, MacLeod e McCarty, 1944), a descoberta da estrutura da dupla hélice (Watson, Crick e Franklin, 1953), a decifração do código genético (Nirenberg, Khorana e Holley, nos anos 1960), e, a partir dos anos 1970, o surgimento das primeiras técnicas de manipulação genética.
Em 2025, já não tratamos apenas de “testemunhar” a genética, mas de modificá-la com ferramentas como o CRISPR-Cas9, que tornou os genes literalmente editáveis para curar doenças, criar plantas resistentes à crise climática e permitir a desextinção de espécies. O que, é claro, também coloca questões éticas inadiáveis. A humanidade estará preparada para lidar com tamanho poder? Nesta edição de #FuturoPresente, vamos investigar a edição genética.
Os genes “sob medida” – o que é edição genética e como ela começou?
Quando falamos em “edição”, pensamos em ferramentas digitais para vídeo, áudio ou arquivos gráficos para acessar, recortar e moldar algo novo a partir de peças pré-existentes. Nada de estranho nisso. No momento em que a ideia é transferida para uma escala nanométrica, porém, gera dúvidas: neste caso, o uso de “edição” não seria muito mais uma licença poética do que algo real? Na verdade, o termo é exato, e diz respeito, de fato, ao uso de ferramentas de alta tecnologia, físicas, químicas e biológicas, para transformar genes.

Quanto ao desenvolvimento da edição genética, é possível presumir que uma técnica tão sofisticada seja resultado de uma trajetória que envolveu muitos cientistas e, em alguns momentos, saltos disruptivos. Exatamente!
Combinando genes
Tudo começa no início dos anos 1970, partindo das descobertas anteriores. Nessa década, a ciência já conseguia decifrar os genes, cujos estudos, aliás, renderam prêmios Nobel a pesquisadores nos anos de 1933, 1958, 1962 e 1968.

Em 1972, Paul Berg, pesquisador da Universidade de Stanford, desenvolveu o chamado DNA recombinante, uma “partícula de vida” estável que unia os genes de dois organismos diferentes. Para isso, ele usou uma “tesoura molecular” formada por enzimas para cortar trechos específicos do DNA. Em seguida, trouxe os componentes que queria incorporar e usou uma “cola” – um componente chamado “DNA ligase” para unir o conjunto. Resultado: Uma molécula artificial estável, que misturava genes de espécies diferentes – algo que, até então, só a natureza fazia por mutações ou recombinação natural.
Cada célula do nosso corpo, com exceção dos glóbulos vermelhos, contém uma molécula chamada DNA (ácido desoxirribonucleico), que carrega a informação genética de que necessita e define quem somos e como somos. E Berg, ao unir porções distintas, fez algo que até então era uma exclusividade da natureza e dos processos evolucionários. Por questões éticas e de biossegurança, porém, ele utilizou apenas fragmentos de vírus e bactérias – nenhum ser vivo foi modificado no processo.
Logo depois, em 1973, os pesquisadores Stanley Cohen e Herbert Boyer (das universidades da Califórnia e Stanford) deram o passo além, criando os primeiros organismos vivos geneticamente modificados. Eram bactérias editadas que poderiam se replicar transmitindo a nova carga genética para seus herdeiros. Essa técnica pioneira abriu caminho para a insulina humana produzida por bactérias – a primeira terapia geneticamente modificada, no ano de 1978. Em síntese: nascia, oficialmente, a Engenharia Genética.
Letramento genético
O resultado prático dos estudos de Berg, Cohen e Boyer acelerou os estudos em genética. Uma das grandes questões dizia respeito à precisão na leitura dos genes. Faz todo sentido: afinal, se a ideia é trabalhar com as peças de um quebra-cabeças, é preciso saber onde elas estão e como são.
E foi por aí que seguiu o trabalho de Frederick Sanger, que em 1980 recebeu o prêmio Nobel de Química (junto com Walter Gilbert) por desenvolver o primeiro método eficiente de sequenciamento do DNA, o “sequenciamento por terminação de cadeia”, a partir da ordem das bases que formam a molécula (A, T, C, G).
O método de Sanger foi essencial para outra etapa crítica dos estudos em genética: o mapeamento do genoma humano, realizado pelo Projeto Genoma Humano, iniciado em 1990 e concluído em 2003. Em tempo: os seres humanos possuem algo entre 20 mil e 25 mil genes – um número menor de genes que o da cebola, que chega a 60 mil!
Atualmente, os cientistas utilizam técnicas mais avançadas de sequenciamento. Contudo, o método de Sanger é tão confiável que é utilizado para a validação de resultados em pesquisas e diagnósticos.
PCR: a genética chega ao “CSI”
Nos anos seguintes, mais novidades. Em 1983, o bioquímico Kary Mullis desenvolveu a técnica de PCR – sigla, em inglês, para Reação em Cadeia da Polimerase (Polymerase Chain Reaction) –, que possibilitou a amplificação de fragmentos de DNA. Uma descoberta tão importante que garantiu a Mullis o prêmio Nobel de Química de 1993, junto com Michael Smith.
Mas, o PCR é importante por quê? Para responder, pense nos filmes tipo “CSI”: quando usam a técnica para copiar e “ampliar” um trecho específico de DNA (extraído de uma mancha de sangue ou suor, por exemplo), os cientistas forenses geram uma quantidade de moléculas que permite comparar e identificar o dono da amostra.
A mesma expansão-identificação permite identificar vírus em testes-diagnóstico, obter informações sobre restos arqueológicos e paleontológicos, realizar investigações de ancestralidade e – chegamos ao ponto do nosso artigo – sequenciar, clonar e editar genes.
CRISPR: a chave das sequências repetidas de DNA
Quem lê matérias sobre edição genética fatalmente encontra uma sigla: “CRISPR”, que aparece tanto porque se conecta ao “corta-e-cola” de genes. CRISPR é o acrônimo para Clustered Regularly Interspaced Short Palindromic Repeats – Repetições Palindrômicas Curtas, Organizadas em Grupos e Regularmente Interespaçadas. São sequências repetitivas de DNA que aparecem dentro dos conjuntos de genes.
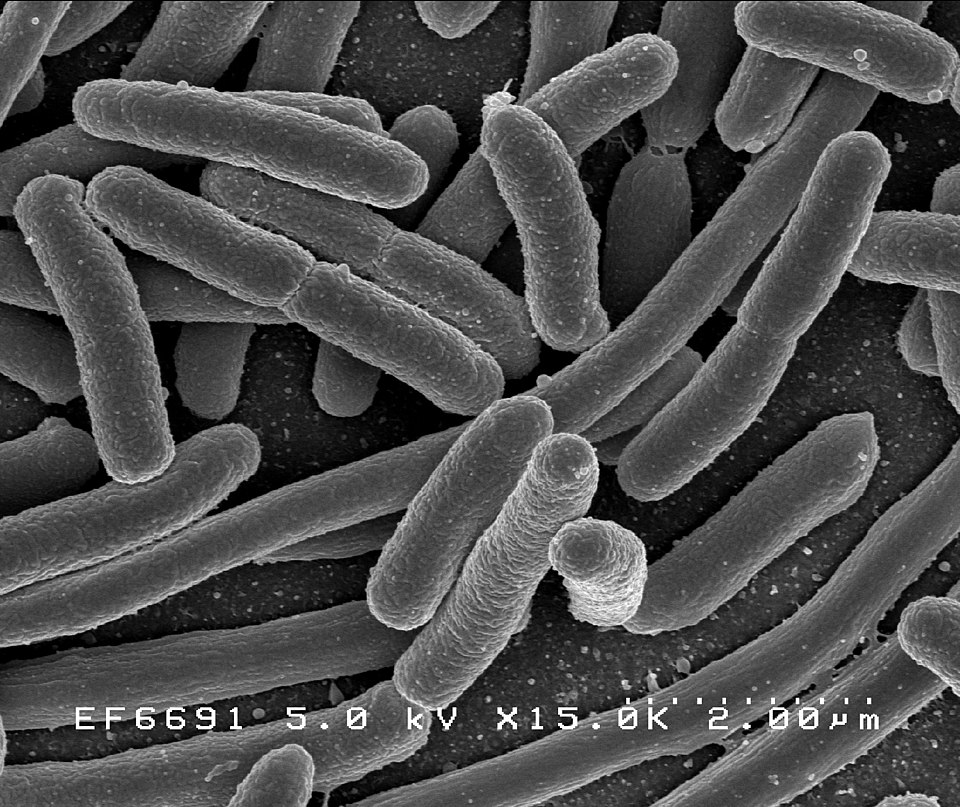
Elas foram descobertas em 1987 pelo pesquisador Yoshizumi Ishino, à época doutorando pela universidade de Kyoto, Japão, durante uma investigação sobre os genes da Escherichia coli, bactéria causadora de infecções gastrointestinais graves.
No início, os cientistas não sabiam o porquê dessas sequências repetitivas de genes. No início do século XXI, porém, eles chegaram à conclusão de que elas faziam parte do sistema de resposta imunológica das bactérias contra vírus. Isso porque, em seus interstícios, elas guardavam uma espécie de biblioteca viral com fragmentos destes invasores. E foi então que a história deu um salto!
A “biblioteca-tesoura” do DNA
Em 2007, os biólogos moleculares Philippe Horvath e Rodolphe Barrangou perceberam que as bactérias usavam as próprias sequências CRISPR para identificar, cortar e destruir o DNA de vírus invasores.
Fantástico! Mas, e se a gente usasse essa “biblioteca-tesoura” do CRISP para cortar sequências de DNA? Foi isso que, em 2012, fizeram as cientistas Jennifer Doudna e Emmanuelle Charpentier, das universidades de Umea (Suécia) e Berkeley (EUA) – a descoberta lhes rendeu o prêmio Nobel de Química de 2020. Em 2013, Feng Zhang, do Massachusetts Institute of Technology (MIT), conseguiu adaptar o sistema CRISPR para as células humanas, o que tornou possível a edição genômica voltada à saúde – o que, por sua vez, gerou grandes descobertas e, também, sérias preocupações éticas.

Um grande dilema
Imagine a hipótese de editar genes para criar seres humanos com características específicas – fisicamente mais fortes, mais resistentes a certas doenças, mais dóceis, mais brigões… afinal, isto seria algo bom ou ruim? Essa pergunta é crucial na discussão sobre edição genética.
Uma primeira edição de genes humanos buscando corrigir falhas congênitas foi feita em 2015 pelo pesquisador Junjiu Huang, da universidade Sun Yatsen (China), em uma tentativa de eliminar um defeito no gene HBB, responsável pela beta-talassemia, doença sanguínea hereditária e fatal. Em 2017, cientistas dos Estados Unidos também usaram o CRISPR para corrigir mutações genéticas nocivas em fetos.
Até aí, em princípio, tudo parecia bem – ainda que, para muitos cientistas, essas intervenções fossem consideradas arriscadas justamente pela falta de maiores conhecimentos, por exemplo, sobre respostas genéticas secundárias decorrentes da edição.
Até que, em 2018, alguém “ultrapassou a linha”: He Jiankui, então na Universidade de Ciência e Tecnologia do Sul da China, que anunciou o nascimento de dois bebês cuja genética havia sido editada para evitar a contaminação pelo vírus HIV. Eram embriões sem defeitos genéticos que foram deliberadamente “editados”. Como a República Popular da China – e a maioria dos países que possuem legislação a respeito – proíbe edições genéticas desse tipo (em embriões saudáveis), ele acabou processado, demitido da universidade e condenado a dois anos de prisão.
O futuro com a tesoura na mão
Na medida em que as tecnologias avançam, o dilema ético fica mais claro. Os países devem definir e transformar em lei normas claras e rigorosas em relação ao CRISPR, que deve ter como foco, exclusivamente, a correção de problemas genéticos preexistentes.
A edição genética também pode ser utilizada para o desenvolvimento de espécies agrícolas mais resistentes às mudanças climáticas (como no caso de uma pesquisa brasileira que busca uma soja mais resistente à seca) e, também, para a “desextinção” de espécies, algo de que tratamos em uma edição anterior da série #FuturoPresente.

Mesmo essas finalidades, porém, devem ser examinadas com cuidado, até porque elas geram questões relevantes. Por exemplo: vale mais a pena investir na desextinção ou na proteção de espécies ameaçadas?
Novidades extraordinárias
Feita essa reflexão – o debate vai muito mais longe –, podemos passar às pesquisas mais recentes. Em 2023, o Reino Unido – país-chave na pesquisa genética – aprovou a primeira terapia CRISPR para tratar a anemia falciforme e a beta-talassemia, doenças genéticas graves que afetam muitas pessoas.
No ano passado, uma nova técnica de edição, chamada “Prime Editing” – mais precisa que o CRISPR tradicional, que se mostra impreciso em certos alvos –, entrou em fase de testes clínicos em seres humanos para o tratamento de males hereditários como a doença de Tay-Sachs, que provoca deterioração neurológica.
E, há algumas semanas (junho de 2025), os cientistas do projeto Synthetic Human Genome (SynHG), formado por pesquisadores baseados no Reino Unido, anunciaram o objetivo de produzir sequências genéticas avançadas do zero, ou seja, sintéticas.
É um passo além, uma edição ainda mais profunda: ao invés de utilizar fragmentos genéticos naturais, os cientistas querem construí-los a partir das “bases nitrogenadas” – Adenina (A), Timina (T), Citosina (C) e Guanina (G) – para, em seguida, montá-los em sequências. Ou seja: além de acessar e encaixar as peças do quebra-cabeças, eles também vão construí-las.
Até agora, essa edição sintética tem sido possível em estruturas genéticas simples, como as de bactérias. A meta, porém, é chegar ao nível humano até 2030. Essas conquistas vão trazer novos dilemas éticos relacionados a um tema tão profundamente humano.

Podemos pensar, por exemplo, na geração de “super soldados” ou, então, de uma naturalização da eugenia, que vem a ser a escolha e eleição de grupos humanos por suas características genéticas. Isso é algo tremendamente arriscado. Na medida, porém, em que a ciência não caminha para trás – isto é, os conhecimentos adquiridos não são perdidos –, resta à sociedade por meio de seus representantes e, certamente, da educação, estabelecer limites éticos sólidos e inegociáveis. Em síntese: as perspectivas são extraordinárias, mas também pedem muita atenção.
Isso é #FuturoPresente – porque o conhecimento nasce na escola.
Links interessantes:
🧬 G1 – Cientistas testam primeira soja editada geneticamente no Brasil
🧫 BBC Brasil – O polêmico projeto para criar do zero DNA humano artificial
🧬 BBC Brasil – Nova técnica de edição de DNA poderá curar até ‘89% das doenças genéticas’ no futuro
🧫 Tecmundo – CRISPR: Bebê com doença rara é o primeiro paciente do mundo a receber terapia de edição genética
